Sistem Periodik Unsur - Sampai saat ini, sudah dikenal 118 macam unsur dengan sifat yang khas untuk setiap unsur. Jika unsur-unsur itu tidak disusun secara tepat maka akan mengalami kesukaran dalam mempelajari sifat-sifatnya. Oleh sebab itu, sejak dulu para ilmuwan berusaha menggolongkan unsur-unsur berdasarkan sifat-sifatnya. Bagaimanakah unsur-unsur disusun dalam sistem periodik? Apakah yang dimaksud dengan sistem periodik unsur? Bagaimanakah perkembangan dari penyusunan sistem periodik? Anda akan mengetahui jawabannya jika Anda pelajari uraian yang disajikan pada bab ini.
A. Perkembangan Sistem Periodik
Sistem periodik adalah suatu tabel berisi identitas unsur-unsur yang dikemas secara berkala dalam bentuk periode dan golongan berdasarkan kemiripan sifat-sifat unsurnya.
1. Sistem Periodik Klasik
Ilmuwan pertama yang mengembangkan sistem periodik unsur adalah Johan W. Dobereiner. Sistem periodik unsur-unsur yang dikembangkannya didasarkan pada nomor massa atom. Menurut Dobereiner, jika nomor massa atom unsur A ditambah nomor massa atom unsur B, kemudian dirataratakan maka akan dihasilkan nomor massa atom unsur C. Ketiga unsur ini akan memiliki sifat yang mirip. Kelompok unsur tersebut oleh Dobereiner dinamakan triade.
Contoh :
Massa atom Cl = 35
Massa atom I = 127
Jadi, sifat unsur bromin akan mirip dengan unsur klorin dan iodin.
Pada perkembangan berikutnya, John Newland menemukan hubungan antara sifat unsur dan massa atom menurut pola tertentu. Jika unsur-unsur dideretkan menurut kenaikan nomor massa atom maka unsur kedelapan memiliki sifat mirip dengan unsur pertama. Pola ini dinamakan Hukum Oktaf. Namun, pada perkembangan selanjutnya ditemukan beberapa unsur yang tidak sesuai dengan Hukum Oktaf, misalnya: Cr tidak mirip dengan Al; Mn tidak mirip dengan P; Fe tidak mirip dengan S; dan yang lainnya.
Catatan :
Hukum Oktaf dari Newland:
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Li | Be | B | C | N | O | F |
Na | Mg | Al | Si | P | S | Cl |
K | Ca | Cr | - | Mn | Fe |
Jerman, Lothar Meyer, menyusun tabel periodik unsur-unsur secara terpisah di setiap negaranya. Sistem periodik Mendeleev didasarkan pada nomor massa atom, sedangkan sistem periodik Meyer didasarkan pada massa jenis atom. Walaupun dasar penggolongan sistem periodik berbeda, tetapi hasilnya hampir sama. Mendeleev menyusun sistem periodik unsur-unsur dengan cara menempatkan unsur-unsur ke dalam bentuk baris dan kolom.
Unsur-unsur dalam kolom yang sama ini memiliki sifat-sifat yang mirip. Unsur yang terdapat di bawah aluminium disebut eka-aluminium dengan lambang Ea. Menurut Mendeleev, sifat-sifat unsur ini dapat diprediksi berdasarkan perbandingan terhadap unsur-unsur tetangganya. Hasil prediksi Mendeleev terhadap unsur eka-aluminium, yaitu nomor massa 68, massa jenis 5,9 g/cm3, titik leleh rendah, titik didih tinggi, dan rumus oksidanya Ea2O3. Sistem periodik Mendeleev dapat dilihat pada Tabel 1.
Tabel 1. Sistem Periodik Menurut Mendeleev
Periode | Gol.I | Gol.II | Gol.III | Gol.IV | Gol.V | Gol.VI | Gol.VII | Gol.VIII |
1 | H=1 | |||||||
2 | Li=7 | Be=9,4 | B=11 | C= 12 | N=14 | O= 16 | F= 19 | |
3 | Na=23 | Mg=24 | Al=27,3 | Si=28 | P= 31 | S= 32 | Cl= 35,5 | |
4 | K=39 | Ca=40 | – = 44 | –=48 | V= 51 | Cr= 52 | Mn= 55 | Fe= 56; Co= 59 Ni= 59; Cu= 63 |
5 | Cu=63 | Zn=65 | –= 68 | –=72 | As= 75 | Se= 78 | Br= 80 | |
6 | Rb=85 | Sr=87 | Yt=88 | Zr=90 | Nb= 94 | Mo= 96 | –= 100 | Ru=104; Rh=104 Pd=106; Ag=108 |
7 | Ag=108 | Cd=112 | In=113 | Sn=118 | Sb= 122 | Te= 125 | J= 127 | |
8 | Cs=133 | Ba=137 | Di=138 | Ce=140 | – | – | – | – – – – – |
9 | – | – | – | La=180 | – | – | – | Os=195; Ir= 197 |
10 | – | – | Er=178 | Pb= 207 | Ta= 182 | W= 184 | – | Pt=198; Au=199 |
11 | Au=199 | Hg=200 | Tl=204 | Th=231 | Bi= 208 | – | – | – – – – – |
Pada 1874, ahli kimia Prancis, Paul Émile Lecoq de Bois-baudran menemukan unsur galium (perhatikan Gambar 1).
Sifat-sifat unsur galium tidak berbeda dengan eka-aluminium yang diramalkan oleh Mendeleev. Jadi, eka-aluminium tiada lain adalah galium. Sifat galium menurut prediksi Mendeleev ditunjukkan pada Tabel 2.
 |
| Gambar 1. Galium |
Tabel 2. Prediksi Mendeleev pada Unsur Galium
Sifat | Ramalan Eka-Aluminium | Galium yang Ditemukan |
Nomor massa | 68 | 67,7 |
Massa jenis | 5,9 g/cm3 | 5,91 g/cm3 |
Titik leleh | Rendah | 30,1 °C |
Titik didih | Tinggi | 1983 °C |
Keberhasilan Mendeleev dalam memprediksi unsur-unsur yang belum ditemukan waktu itu, menjadikan sistem periodik Mendeleev lebih diterima oleh masyarakat ilmiah dibandingkan sistem periodik yang dikembangkan oleh Lothar Meyer.
Sekilas Kimia
Sekilas Kimia
Dmitri Mendeleev
(1834 -1907)
Kemampuan memprediksi Mendeleev ditunjukkan lagi ketika skandium (eka-boron) ditemukan pada 1879 dan germanium (ekasilikon) ditemukan pada 1886. Kedua unsur itu memiliki sifat-sifat mirip sesuai ramalan Mendeleev. Kemampuan memprediksi Mendeleev inilah yang menyebabkan sistem periodiknya lebih diterima oleh masyarakat. (Sumber : Jendela IPTEK: Materi, 1997)
Contoh Soal 1 :
Dasar Pemikiran Disusunnya Tabel Periodik Mendeleev
Berdasarkan apakah Mendeleev menyusun tabel periodik unsur-unsur? Mengapa sistem periodik dari Mendeleev lebih dikenal daripada model Lothar Meyer?
Kunci Jawaban :
Dasar yang dipakai Mendeleev menyusun tabel periodik unsur-unsur adalah kenaikan nomor massa atom. Kemampuan prediksi Mendeleev menjadikan tabel periodik yang disusunnya lebih dikenal masyarakat ilmiah.
2. Sistem Periodik Modern
Bentuk sistem periodik modern adalah berupa tabel panjang yang dimodifikasi dengan cara mengeluarkan dua deret unsur-unsur yang tergolong unsur-unsur transisi dalam, yaitu unsur-unsur dimulai dengan nomor atom 58 sampai 71 (golongan lantanida) dan nomor atom 90 sampai 103 (golongan aktinida).
Dalam sistem periodik modern, unsur-unsur disusun menurut kenaikan nomor atom, bukan nomor massanya dan disusun ke dalam periode dan golongan. Terdapat 7 periode dan 18 golongan. Periode 1 dihuni 2 unsur; periode 2 dan 3 dihuni 8 unsur; periode 4 dan 5 dihuni 18 unsur; periode 6 dan 7 dihuni 32 unsur. Oleh karena terlalu panjang maka pada periode 6 dan 7, unsur dengan nomor atom 58–71 dan 90–103 dikeluarkan dari tabel dan ditempatkan di bawah tabel (perhatikan Gambar 2).
Setiap kolom dalam tabel periodik modern mengandung informasi tentang lambang unsur, nomor atom, nomor massa, wujud, dan informasi lainnya, seperti ditunjukkan pada sistem periodik unsur-unsur berikut.
 |
 |
| Gambar 2. Tabel periodik dan informasi kolom yang penting |
B. Periode dan Golongan
Periode berisi unsur-unsur dalam baris horizontal. Golongan berisi unsur-unsur dengan kolom vertikal. Dalam tabel periodik modern, golongan diberi label. Label yang dipakai ada yang mengikuti aturan lama, ada juga yang mengikuti aturan baru (IUPAC). Menurut aturan lama, nomor golongan ditandai dengan angka romawi diikuti huruf A dan B, sedangkan menurut aturan IUPAC menyarankan golongan dinomori mulai dari angka 1 sampai angka 18.
Contoh :
Unsur-unsur pada kolom ke-13, menurut aturan lama diberi nomor IIIA, sedangkan menurut IUPAC diberi nomor 13. Unsur-unsur golongan A disebut unsur-unsur utama dan unsur-unsur golongan B disebut unsur-unsur transisi, atau transisi deret pertama. Dua baris yang diletakkan di bawah tabel dinamakan unsur-unsur transisi dalam (golongan aktinida dan lantanida).
Pada tabel periodik modern, unsur-unsur dapat digolongkan ke dalam logam, bukan logam, dan semi-logam (metalloid). Penggolongannya dapat dipahami dengan mudah dengan memerhatikan bagan Gambar 3. yang menampilkan beberapa unsur utama. Unsur-unsur logam berada dalam golongan IA sampai IIIA dan unsur transisi, unsur-unsur bukan logam berada dalam golongan VA sampai VIIIA. Adapun golongan IVA dengan arah diagonal ke kanan bawah, umumnya semi-logam.
Contoh Soal 2 :
 |
| Gambar 3. Pengelompokan unsur-unsur dalam tabel periodik modern |
Menentukan Golongan dan Periode Unsur-Unsur
a. Dalam kata 'CInTa' terdapat berapa macam unsur dan berada pada golongan serta periode berapa?
b. Susun satu kalimat dari unsur-unsur yang ada dalam golongan dan periode berikut:
• golongan IA, periode 2 dan 3;
• golongan IIA, periode 4;
• golongan VA, periode 2;
• golongan golongan, IVB periode 4; dan
• golongan IA, periode 4.
Kunci Jawaban :
a. Dalam kata CInTa terdapat 3 unsur, yaitu C (karbon), In (indium), dan Ta (tantalum). Masing-masing terdapat dalam golongan dan periode:
C = IVA atau 14, periode 2
In = IIIA atau 13, periode 5
Ta = VB atau 5; periode 6
b. Li, Na, Ca, N, Ti, K
Jadi, susunan kalimatnya adalah LiNa CaNTiK.
Catatan :
IUPAC (International Unions of Pure and Applied Chemistry) adalah suatu organisasi kimia dunia yang menetapkan berbagai aturan dan kebijakan terkait tentang Ilmu Kimia.
C. Sistem Periodik dan Konfigurasi Elektron
Dalam tabel periodik modern, unsur-unsur dalam satu golongan memiliki sifat-sifat yang mirip, demikian pula dalam satu periode memiliki sifat-sifat beraturan. Mengapa demikian? Kemiripan dan keteraturan sifat-sifat unsur dalam tabel periodik ada kaitannya dengan konfigurasi elektron atom dari unsur-unsur itu.
1. Periode dan Konfigurasi Elektron
Adakah hubungan antara jumlah unsur yang terdapat dalam tiap periode dan konfigurasi elektronnya? Jika Anda simak tabel periodik pada baris mendatar kemudian dihubungkan dengan jumlah elektron dalam setiap lintasan atau orbit, tentu Anda akan memperoleh kesimpulan sebagai berikut.
- Jumlah unsur dalam periode 1 menyatakan jumlah maksimum elektron yang menghuni orbit ke-1, yaitu 2 macam unsur.
- Jumlah unsur dalam periode 2 menyatakan jumlah maksimum elektron yang menghuni orbit ke-2, yaitu 8 unsur.
Contoh :
Jumlah elektron maksimum yang dapat menghuni orbit-1 (n = 1) adalah 2 elektron sehingga jumlah unsur yang terdapat dalam periode 1 adalah 2 macam. Demikian juga pada orbit ke-2 (n=2) dapat dihuni maksimum oleh 8 elektron sehingga jumlah unsur pada periode 2 adalah 8 macam.
Pertanyaan selanjutnya adalah adakah hubungan antara posisi unsur-unsur dalam periode dan konfigurasi elektronnya? Untuk menemukan jawabannya, Anda dapat menghubungkannya dengan kedudukan elektron valensi dari atom unsur itu. Jika elektron valensi berada dalam orbit ke-3 maka unsur yang bersangkutan akan menghuni periode 3.
2. Golongan dan Konfigurasi Elektron
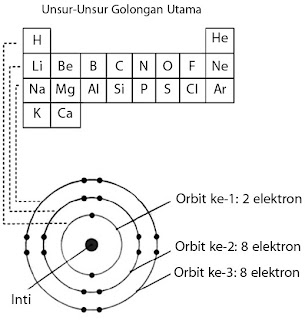 |
| Gambar 4. Hubungan jumlah elektron maksimum dalam setiap orbit dengan jumlah unsur dalam satu periode pada tabel periodik |
Pertanyaan selanjutnya adalah apakah ada hubungan antara golongan dalam tabel periodik dan konfigurasi elektron?
Untuk menemukan jawaban tersebut, kembangkan oleh Anda konfigurasi elektron unsur-unsur, misalnya golongan IA (H, Na, K) dan golongan IIA (Be, Mg, Ca), kemudian temukan kesamaannya pada setiap golongan. Selanjutnya, hubungkan oleh Anda kesamaan konfigurasi elektron dalam setiap golongan dengan nomor golongan, misalnya IA, IIA, IIIA, dan seterusnya.
Contoh Soal 3 :
Hubungan Tabel Periodik dan Konfigurasi Elektron
a. Pada periode dan golongan berapakah suatu unsur memiliki jumlah elektron 8?
b. Pada periode dan golongan berapakah suatu unsur memiliki jumlah elektron 14?
Kunci Jawaban :
a. Konfigurasi elektronnya adalah 2 6.
Jadi, unsur tersebut akan berada pada periode ke-2 dan golongan VIA.
b. Konfigurasi elektronnya adalah 2 8 4
Jadi, unsur tersebut berada pada periode ke-3 dan golongan IVA.
D. Beberapa Sifat Periodik Unsur
Unsur-unsur dalam golongan yang sama memiliki elektron valensi yang sama. Demikian pula unsur-unsur pada periode yang sama, elektron valensinya menghuni orbit yang sama. Oleh karena sifat-sifat unsur ada hubungannya dengan konfigurasi elektron maka unsur-unsur dalam golongan yang sama akan memiliki sifat yang mirip dan dalam periode yang sama akan menunjukkan sifat yang khas secara berkala (periodik) dari logam ke nonlogam. Beberapa sifat periodik unsur di antaranya adalah jari-jari atom, afinitas elektron, energi ionisasi, dan keelektronegatifan.
1. Jari-jari Atom
Jari-jari atom sangat kecil, diduga diameternya sekitar 10–10 m. Satuan yang biasa digunakan untuk menyatakan jari-jari atom adalah angstrom (Å). Satu angstrom sama dengan 10–10 m.
Tabel 3. Jari-Jari Atom Menurut Golongan (dalam satuan pm)
Golongan | Unsur | Jari-Jari | ||
Atom | Kation | Muatan | ||
IA | Li Na K Rb | 135 154 196 211 | 60 95 133 148 | +1 +1 +1 +1 |
IIA | Be Mg Ca | 90 130 174 | 31 65 99 | +2 +2 +2 |
IIIA | Al Ga In | 143 122 162 | 50 62 81 | +3 +3 +3 |
VIIA | F Cl Br I | 64 114 133 | 136 181 195 216 | –1 –1 –1 –1 |
VIA | O S Se | 66 104 117 | 140 184 198 | –2 –2 –2 |
VA | N P As | 70 110 125 | 171 212 – | –3 –3 – |
Sumber: Chemistry with Inorganic Quantitative Analysis, 1989 | ||||
Jari-jari atom didefinisikan sebagai setengah jarak antara dua inti atom yang berikatan dalam wujud padat (perhatikan Gambar 5).
Hasil pengukuran ditunjukkan pada Tabel 3. Jika Anda perhatikan Tabel 3. maka akan terlihat adanya keteraturan jari-jari, baik dalam golongan yang sama maupun dalam periode yang sama.
 |
| Gambar 5. Jari-jari atom |
Perhatikanlah jari-jari atom dari atas ke bawah dalam golongan yang sama. Apakah yang dapat Anda simpulkan mengenai jari-jari atom dalam golongan yang sama? Bertambahnya jari-jari atom dari atas ke bawah dalam golongan yang sama disebabkan bertambahnya orbit (lintasan) elektron. Bertambahnya orbit menyebabkan volume atom mengembang sehingga jari-jari atom meningkat.
Perhatikanlah jari-jari atom dari kiri ke kanan dalam periode yang sama. Apakah yang dapat Anda simpulkan mengenai jari-jari atom dalam periode yang sama?
Catatan :
Konversi satuan panjang :
sentimeter (cm) | 10-2 m |
milimeter (mm) | 10-3 m |
mikrometer ( μ m) | 10-6 m |
nanometer (nm) | 10-9 m |
angstrom (Å) | 10-10 m |
pikometer (pm) | 10-12 m |
femtometer (fm) | 10-15 m |
attometer (am) | 10-18 m |
Penurunan jari-jari atom dari kiri ke kanan dalam periode yang sama disebabkan bertambahnya jumlah proton di dalam inti atom, sedangkan jumlah orbitnya sama. Dengan bertambahnya jumlah proton, tarikan inti
terhadap elektron valensi makin kuat sehingga terjadi pengerutan volume atom. Akibatnya, jari-jari atom dari kiri ke kanan mengecil (perhatikan Gambar 6).
Contoh Soal :
 |
| Gambar 6. Jari-jari atom dipengaruhi oleh jumlah proton dalam inti. |
Menentukan Kecenderungan Jari-Jari Atom
Urutkan unsur-unsur berikut menurut kenaikan jari-jarinya: Na, K, Mg, dan Ca. Jelaskan alasannya.
Kunci Jawaban :
Na dan K berada dalam golongan yang sama, tetapi atom K memiliki orbit terluar lebih jauh dari inti sehingga jari-jari atom K lebih panjang daripada Na. Demikian pula atom Mg dan Ca, dengan jari-jari atom Ca lebih panjang dari Mg. Na dan Mg berada pada periode yang sama dan jari-jari atom Na lebih panjang dari Mg sebab muatan inti atom Mg (ditunjukkan oleh naiknya nomor atom) lebih besar daripada Na. Demikian pula atom K dan Ca, dengan jari-jari atom K lebih panjang dari Ca.
Dengan demikian, dapat disimpulkan bahwa urutan kenaikan jari-jari atom adalah Mg < Na < Ca < K.
2. Energi Ionisasi
Energi ionisasi adalah energi yang diperlukan untuk mengeluarkan elektron valensi dari suatu atom atau ion dalam wujud gas.
Nilai energi ionisasi bergantung pada jarak elektron valensi terhadap inti atom. Makin jauh jarak elektron valensi terhadap inti atom, makin lemah tarikan inti terhadap elektron sehingga energi ionisasi makin kecil. Nilai energi ionisasi unsur-unsur utama ditunjukkan pada Gambar 7. yang digambarkan secara grafik.
Pada periode yang sama, dari kiri ke kanan jari-jari atom relatif tetap, tetapi muatan inti bertambah. Hal ini menyebabkan tarikan inti terhadap elektron valensi makin besar. Bagaimanakah kecenderungan energi ionisasi jika diurutkan dari kiri ke kanan pada periode yang sama?
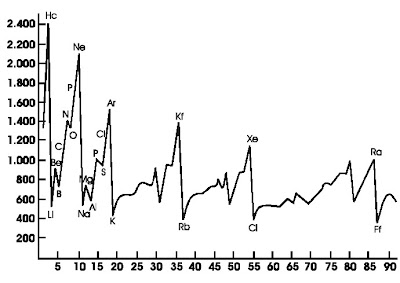 |
| Gambar 7. Grafik energi ionisasi pertama unsur-unsur golongan utama. |
Selain muatan inti atom, energi ionisasi juga dipengaruhi oleh konfigurasi elektron, terutama konfigurasi elektron dengan jumlah elektron valensi sebanyak 8 (golongan VIIIA, gas mulia). Perhatikan grafik pada Gambar 7, pada setiap periode, energi ionisasi terbesar dimiliki oleh unsur-unsur gas mulia (He, Ne, Ar, Kr, dan Xe). Unsurunsur gas mulia adalah contoh unsur-unsur paling stabil. Kestabilan ini disebabkan atom-atom gas mulia memiliki elektron valensi paling banyak (8 elektron). Oleh karena itu, untuk mengeluarkan elektron valensi dari atom gas mulia memerlukan energi ionisasi yang sangat besar.
Contoh Soal 5 :
Menentukan Kecenderungan Energi Ionisasi
Urutkan atom-atom berikut: Na, Mg, K, dan Ca menurut kenaikan energi ionisasinya, kemudian jelaskan alasannya.
Kunci Jawaban :
Pada periode yang sama, dari kiri ke kanan energi ionisasi bertambah akibat bertambahnya muatan inti. Jadi, energi ionisasi Mg lebih besar dari Na. Demikian pula energi ionisasi Ca lebih besar dari K. Dalam golongan yang sama, dari atas ke bawah energi ionisasi berkurang akibat orbit elektron makin jauh dari inti. Jadi, energi ionisasi Na lebih besar dari K dan energi ionisasi Mg lebih besar dari Ca. Dengan demikian, dapat disimpulkan bahwa urutan energi ionisasi adalah K < Na < Ca < Mg.
3. Afinitas Elektron
Afinitas elektron adalah perubahan energi atom ketika elektron ditambahkan kepada atom itu dalam keadaan gas. Contoh:
Berbeda dengan energi ionisasi, afinitas elektron dapat berharga positif atau negatif. Jika satu elektron ditambahkan kepada atom yang stabil dan sejumlah energi diserap maka afinitas elektronnya berharga positif. Jika dilepaskan energi, afinitas elektronnya berharga negatif.
Tabel 4 Afinitas Elektron Unsur-Unsur Golongan Utama
IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
H = –73 | Be = 240 | B = 83 | C = 123 | N = 0,0 | O = 141 | F = 322 | He = 21 |
Li = –60 | Mg = 230 | Al = 50 | Si = 120 | P = 74 | S = 200 | Cl = 349 | Ne = 29 |
Na = –53 | Ca = 156 | Ga = 36 | Ge= 116 | As = 77 | Se= 195 | Br = 325 | Ar = 35 |
K = –48 | Sr = 168 | In = 34 | Sn= 121 | Sb= 101 | Te= 183 | I = 295 | Kr = 39 |
Rb = –47 | Ba = 52 | Tl = 50 | Pb= 101 | Bi = 101 | Po= 270 | At = 270 | Xe = 41 |
Secara umum, nilai afinitas elektron dalam golongan yang sama dari atas ke bawah menurun, sedangkan pada periode yang sama dari kiri ke kanan meningkat. Nilai afinitas elektron umumnya sejalan dengan jari-jari atom. Makin kecil jari-jari atom, nilai afinitas elektron makin tinggi. Sebaliknya, makin besar jari-jari atom, nilai afinitas elektron kecil.
Contoh Soal 6 :
Menentukan Kecenderungan Afinitas Elektron
Urutkan atom-atom berikut menurut kenaikan afinitas elektronnya: S, Cl, dan P.
Kunci Jawaban :
Afinitas elektron adalah perubahan energi ketika atom menerima elektron. Pada periode yang sama, dari kiri ke kanan dalam tabel periodik, afinitas elektron umumnya meningkat. Jadi, dapat disimpulkan bahwa afinitas elektron untuk P < S < Cl.
4. Keelektronegatifan Atom
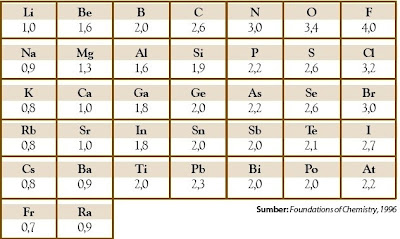
Keelektronegatifan didefinisikan sebagai kecenderungan suatu atom dalam molekul untuk menarik pasangan elektron yang digunakan pada ikatan ke arah atom bersangkutan. Skala keelektronegatifan yang dipakai sampai sekarang adalah yang dikembangkan oleh Pauling sebab lebih lengkap dibandingkan skala keelektronegatifan yang lain. Pauling memberikan skala keelektronegatifan 4 untuk unsur yang memiliki energi ionisasi dan energi afinitas elektron tinggi, yaitu pada unsur florin, sedangkan unsur-unsur lainnya di bawah nilai 4.
Tabel 5 Keelektronegatifan Beberapa Unsur Menurut Golongan dan Periode pada Tabel Periodik
Pada tabel periodik, unsur florin yang ditetapkan memiliki keelektronegatifan 4 (terbesar) berada di ujung kanan paling atas. Adapun Unsur fransium yang memiliki keelektronegatifan terendah yaitu 0,7 berada di kiri paling bawah dalam tabel periodik.
Sekilas Kimia :
Ilmuwan yang terlibat dalam mengembangkan skala keelektronegatifan di antaranya Sanderson, Mulliken, dan Pauling. Keelektronegatifan yang diterima publik adalah dari Pauling sebab didasarkan pada data energi ikatan yang dapat diukur. (Sumber: dlib.org)
Contoh Soal 7 :
 |
Sekilas Kimia :
Linus Pauling
(1901-1994)
Contoh Soal 7 :
Menentukan Kecenderungan Skala Keelektronegatifan
Nomor atom unsur X, Y, dan Z berturut-turut adalah 11, 15, dan 20. Urutkan unsur-unsur tersebut berdasarkan kenaikan skala keelektronegatifannya.
Kunci Jawaban :
Unsur-unsur tersebut berada pada golongan dan periode sebagai berikut:
X: golongan IA dan periode ke-3
Y: golongan VA dan periode ke-3
Z: golongan IIA dan periode ke-4
Berdasarkan data pada Tabel 2.5, skala keelektronegatifan X = Na, Y = P, dan Z = Ca.
Jadi, urutan skala keelektronegatifannya adalah X < Z < Y.
E. Sifat-Sifat Unsur
Unsur-unsur utama (IA – VIIIA) dalam golongan yang sama memiliki konfigurasi elektron valensi yang sama. Akibatnya, unsur-unsur tersebut memiliki kecenderungan sifat-sifat kimia dan fisika yang mirip, seperti sifat logam, bukan logam, muatan ion, dan kemampuan bereaksi.
1. Unsur-Unsur Golongan IA
Unsur-unsur golongan IA disebut juga unsur-unsur logam alkali. Unsur-unsur golongan alkali semuanya bersifat logam yang sangat reaktif. Kereaktifan unsur-unsur alkali disebabkan memiliki energi ionisasi kecil sehingga cenderung melepaskan elektron valensinya dan membentuk suatu kation bermuatan +1. Beberapa sifat unsur golongan IA dapat dilihat pada Tabel 6.
Tabel 6.Sifat-Sifat Fisik Unsur Golongan IA
Sifat | Li | Na | K | Rb | Cs |
Titik leleh (°C) | 181 | 97,8 | 63,6 | 38,9 | 28,4 |
Titik didih (°C) | 1347 | 883 | 774 | 688 | 678 |
Massa jenis (g/cm3) | 0,53 | 0,97 | 0,86 | 1,53 | 1,88 |
Sumber: General Chemistry (Ebbing), 1990 | |||||
Semua unsur alkali berwarna putih, misalnya perak. Pada suhu kamar, semua unsur alkali berwujud padat kecuali cesium berwujud cair. Natrium adalah logam bersifat lunak sehingga dapat dipotong dengan pisau. Kalium lebih lunak dari natrium. Logam litium, natrium, dan kalium memiliki massa jenis kurang dari 1,0 g/cm3. Akibatnya, ketiga logam tersebut terapung di atas air, tetapi ketiga logam ini sangat reaktif terhadap air dan bereaksi sangat dahsyat yang disertai nyala api (perhatikan Gambar 8).
bawah dalam tabel periodik. Sepotong logam litium jika ditambahkan ke dalam air akan bereaksi dengan air disertai nyala api. Kalium bereaksi lebih dahsyat disertai ledakan dan nyala berwarna ungu. Logam alkali bereaksi dengan oksigen dari udara membentuk oksida logam alkali, seperti Li2O (litium oksida), Na2O2 (natrium peroksida), dan KO2 (kalium superoksida). Li2O padatan berwarna putih, Na2O2 padatan berwarna putih-kekuningan, dan KO2 berwarna kuning-jingga.
Ketika dibakar di udara, semua logam alkali menghasilkan nyala dengan warna yang karakteristik. Uji nyala dapat digunakan untuk mengidentifikasi keberadaan senyawa yang tidak diketahui. Warna yang dihasilkan oleh unsur-unsur golongan IA disebutkan dalam Tabel 7.
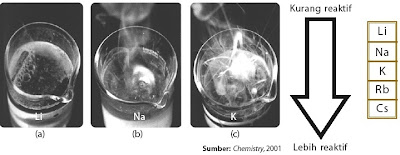 |
| Gambar 8. Logam alkali sangat reaktif dalam air |
 |
| Gambar 9. Uji nyala pada logam alkali. |
Tabel 7 Warna Nyala Unsur Logam Alkali
Unsur | Warna Nyala |
Litium | Merah Jingga |
Natrium | Kuning keemasan |
Kalium | Ungu |
Rubidium | Merah |
Cesium | Biru |
2. Unsur-Unsur Golongan IIA
Unsur-unsur golongan IIA disebut juga logam alkali tanah. Unsur-unsur ini cukup reaktif, tetapi kurang reaktif jika dibandingkan dengan unsur-unsur logam alkali. Logam alkali tanah memiliki energi ionisasi yang cukup rendah sehingga mudah melepaskan kedua elektron valensinya membentuk kation bermuatan positif +2.
Tabel 2.8 Sifat-Sifat Fisika dan Kimia Unsur Golongan IIA
Sifat | Be | Mg | Ca | Sr | Ba |
Titik leleh (°C) | 1278 | 649 | 839 | 769 | 725 |
Titik didih (°C) | 2970 | 1090 | 1484 | 1384 | 1640 |
Massa jenis (g/cm3) | 1,85 | 1,74 | 1,54 | 2,6 | 3,51 |
Keelektronegatifan | 1,5 | 1,2 | 1,0 | 1,0 | 0,9 |
Sumber: General Chemistry (Ebbing), 1990 | |||||
Berilium merupakan logam berwarna abu dan bersifat keras menyerupai besi sehingga cukup kuat untuk menggores kaca. Unsur logam alkali tanah yang lain berupa logam berwarna perak dan lebih lunak dari berilium, tetapi masih lebih keras dibandingkan logam alkali. Berilium kurang reaktif terhadap air. Magnesium bereaksi agak lambat pada suhu kamar, tetapi lebih cepat jika dengan uap air. Kalsium bereaksi cepat dengan air. Logam alkali tanah bereaksi dengan oksigen membentuk oksida logam.
Pembakaran unsur-unsur alkali tanah mengemisikan spektrum warna yang khas. Nyala stronsium berwarna krimson, barium berwarna hijau kuning, dan magnesium memberikan nyala terang. Oleh karena itu, garam-garam alkali tanah sering dipakai sebagai bahan kembang api.
3. Aluminium
Aluminium berada dalam golongan IIIA pada sistem periodik dengan konfigurasi elektron 2 8 3. Oleh karena memiliki 3 elektron valensi maka aluminium dapat membentuk kation bermuatan +3. Beberapa sifat aluminium ditunjukkan pada Tabel 9.
Tabel 9 Sifat Fisika dan Kimia Aluminium
Titik leleh (°C) | Titik didih (°C) | Massa jenis (g/cm3) | Keelektronegatifan |
660 | 2450 | 2,70 | 1,6 |
Sumber: Foundations of Chemistry,1996 | |||
Di alam aluminium terdapat sebagai oksidanya. Corundum adalah mineral keras yang mengandung aluminium oksida, Al2O3. Oksida aluminium murni tak berwarna, tetapi akibat adanya pengotor dapat menghasilkan berbagai warna, seperti safir (berwarna biru) dan ruby (merah tua) (perhatikan Gambar 10).
Aluminium dapat bereaksi dengan gas klorin membentuk aluminium klorida, AlCl3. Aluminium klorida dapat membentuk polimer yang disebut polialuminium klorida (PAC). Senyawa ini banyak dipakai untuk menjernihkan air.
 |
| Gambar 10. Permata ruby dan safir |
4. Karbon dan Silikon
Karbon dan silikon berada dalam golongan IVA dengan masing-masing konfigurasi elektronnya C = 2 4 dan Si = 2 8 4. Kedua unsur ini cenderung membentuk ikatan kovalen. Karbon berbentuk kristal seperti grafit dan intan, ada juga yang nonkristalin (amorf). Grafit bersifat lunak, berwarna hitam mengkilap dengan struktur berlapis, dan dapat menghantarkan listrik (konduktor). Intan merupakan padatan berikatan kovalen paling keras, tidak berwarna dan transparan terhadap cahaya, tetapi intan tidak dapat menghantarkan arus listrik (insulator). Perbedaan intan dan grafit ditunjukkan oleh bentuk strukturnya. Intan membentuk struktur jaringan tiga dimensi, yaitu setiap atom karbon terikat secara kovalen oleh empat atom karbon lain.
Karbon yang berupa amorf adalah arang dan karbon hitam. Kedua jenis karbon ini memiliki struktur seperti grafit, perbedaannya terletak pada tumpukan lapisan. Lapisan pada grafit beraturan, sedangkan pada karbon amorf tidak beraturan (perhatikan Gambar 11).
Catatan :
Kristal adalah bentuk struktur dari suatu zat yang memiliki keteraturan tinggi. Kebalikannya adalah amorf (tidak beraturan).
5. Nitrogen, Oksigen, dan Belerang
Nitrogen berada dalam golongan VA sistem periodik dengan konfigurasi elektron 2 5, oksigen dan belerang berada dalam golongan VIA dengan konfigurasi elektron masing-masing 2 6 dan 2 8 6. Nitrogen dan oksigen berupa gas diatom, sedangkan belerang berupa zat padat dengan rumus molekul S8. Beberapa sifat nitrogen, oksigen, dan belerang ditunjukkan pada Tabel 10.
Tabel 10. Sifat-Sifat Fisika dan Kimia Unsur Nitrogen, Oksigen, dan Belerang
Sifat-Sifat | N | O | S |
Titik leleh (°C) | –210 | –218 | 113 |
Titik didih (°C) | –196 | –183 | 445 |
Massa jenis (g/cm3) | 0,0013 | 0,002 | 2,07 |
Keelektronegatifan | 3,0 | 3,5 | 2,5 |
Afinitas elektron (kJ mol–1) | 0,70 | 141 | –200 |
Sumber: General Chemistry (Ebbing), 1990 | |||
Pada suhu kamar, nitrogen relatif kurang reaktif sebab ikatannya kuat. Akan tetapi, pada suhu tinggi nitrogen bereaksi dengan unsurunsur lain, seperti dengan oksigen menghasilkan NO. Oksigen membentuk molekul diatom O2 dan bentuk alotropnya adalah ozon (O3). Oksigen merupakan gas tidak berwarna, tidak berasa, dan berwujud gas pada keadaan normal. Molekul oksigen merupakan gas reaktif dan dapat bereaksi dengan banyak zat, umumnya menghasilkan oksida. Hampir semua logam bereaksi dengan oksigen membentuk oksida logam.
Keadaan stabil dari belerang adalah bentuk rombik seperti mahkota yang berwarna kuning (perhatikan Gambar 12).
Belerang rombik meleleh pada 113°C menghasilkan cairan berwarna jingga. Pada pemanasan berlanjut, berubah menjadi cairan kental berwarna cokelat-merah.
 |
| Gambar 12. Sampel sulfur rombik merupakan alotrop paling stabil dari sulfur. (Wikia.com) |
Pada waktu meleleh, bentuk mahkota pecah menjadi bentuk rantai spiral yang panjang. Kekentalan meningkat akibat molekul S8 yang padat berubah menjadi rantai berupa spiral panjang. Pada suhu lebih tinggi dari 200°C, rantai mulai pecah dan kekentalan menurun. Belerang (S8) bereaksi dengan oksigen menghasilkan belerang dioksida (SO2) dengan nyala biru yang khas. Oksida yang lain dari belerang adalah SO3, tetapi hanya terbentuk dalam jumlah kecil selama pembakaran belerang dalam udara.
6. Halogen
Unsur-unsur yang menempati golongan VIIA dinamakan unsur-unsur halogen, artinya pembentuk garam. Unsur-unsur halogen sangat reaktif sehingga di alam tidak pernah ditemukan dalam keadaan atomnya, tetapi membentuk senyawa dengan berbagai unsur maupun dengan unsur sejenis. Semua unsur halogen terdapat sebagai molekul diatom, yaitu F2, Cl2, Br2, dan I2. Fluorin dan klorin berwujud gas, fluorin berwarna kuning pucat, sedangkan klorin berwarna kuning kehijauan. Bromin mudah menguap, cairan dan uapnya berwarna cokelat-kemerahan. Iodin berupa zat padat berwarna hitam mengkilap yang dapat menyublim menghasilkan uap berwarna ungu.
Unsur-unsur halogen mudah dikenali dari bau dan warnanya. Halogen umumnya berbau menyengat, terutama klorin dan bromin (bromos, artinya pesing). Kedua gas ini bersifat racun sehingga penanganannya harus hati-hati. Jika uap bromin keluar dari wadahnya maka dalam beberapa saat ruangan akan tampak cokelat-kemerahan.
Unsur-unsur halogen mudah dikenali dari bau dan warnanya. Halogen umumnya berbau menyengat, terutama klorin dan bromin (bromos, artinya pesing). Kedua gas ini bersifat racun sehingga penanganannya harus hati-hati. Jika uap bromin keluar dari wadahnya maka dalam beberapa saat ruangan akan tampak cokelat-kemerahan.
Titik leleh, titik didih, dan sifat-sifat yang lainnya ditunjukkan pada Tabel 11. Kenaikan titik leleh dan titik didih dari atas ke bawah dalam tabel periodik akibat gaya tarik di antara molekul yang makin meningkat dengan bertambahnya jari-jari atom.
Tabel 11 Sifat-Sifat Fisika dan Kimia Unsur Halogen
Sifat-Sifat | F | Cl | Br | I | At |
Titik leleh (°C) | –220 | –101 | –7 | 114 | – |
Titik didih (°C) | –188 | –35 | –59 | 184 | – |
Massa jenis (g/cm3) | 0,0017 | 0,0032 | 3,12 | 4,93 | – |
Keelektronegatifan | 4,0 | 3,0 | 2,8 | 2,5 | 2,2 |
Afinitas elektron (kJ mol–1) | – 328 | –349 | –325 | –295 | 270 |
Kereaktifan halogen dapat dipelajari dari jari-jari atomnya. Dari atas ke bawah, jari-jari atom meningkat sehingga gaya tarik inti terhadap elektron valensi makin lemah. Akibatnya, kereaktifan unsur-unsur halogen makin berkurang dari atas ke bawah. Kereaktifan halogen dapat juga dipelajari dari afinitas elektron. Makin besar afinitas elektron, makin reaktif unsur tersebut. Dari atas ke bawah dalam tabel periodik, afinitas elektron unsurunsur halogen makin kecil sehingga kereaktifan F > Cl > Br > I.
Sekilas Kimia
Neon
Neon mengeluarkan cahaya kemerah-merahan jika listrik dialirkan melalui sebuah pipa vakum udara mengandung neon. Neon ini digunakan untuk menghasilkan tanda-tanda iklan yang berwarna sangat cerah. Cahaya terang yang diperoleh berkaitan dengan tenaga yang digunakan. Gas mulia lain, xenon, digunakan untuk mengisi tabung fluoresen dan menghasilkan cahaya pada lampu-lampu yang digunakan di rumah-rumah. (Sumber: Jendela IPTEK: Kimia, 1997)
7. Gas Mulia
Oleh karena unsur-unsur gas mulia memiliki konfigurasi elektron valensi penuh (8 elektron) maka unsur-unsur gas mulia bersifat stabil. Kestabilan unsur-unsur ini menimbulkan pandangan di kalangan para ilmuwan bahwa unsur-unsur gas mulia sukar membentuk senyawa sehingga gas mulia mendapat julukan gas lembam (inert). Selain konfigurasi elektron yang terisi penuh, ketidakreaktifan gas mulia juga dapat dilihat dari data energi ionisasinya. Makin besar energi ionisasi gas mulia, makin sukar gas tersebut untuk bereaksi.
Tabel 12. Energi Ionisasi Unsur-Unsur Gas Mulia
Gas Mulia | He | Ne | Ar | Kr | Xe | Rn |
Energi ionisasi (kJ mol–1) | 2377 | 2088 | 1527 | 1356 | 1176 | 1042 |
Sumber: General Chemistry (Ebbing), 1990 | ||||||
Gas mulia merupakan gas tidak berwarna, tidak berasa, dan tidak berbau. Argon, kripton, dan xenon sedikit larut dalam air. Helium dan neon tidak dapat larut dalam air. Sifat-sifat fisika lainnya dari unsurunsur gas mulia ditunjukkan pada Tabel 13.
Tabel 13 Sifat-Sifat Fisika Unsur-Unsur Gas Mulia
Sifat Fisik | He | Ne | Ar | Kr | Xe | Rn |
Massa jenis (g/cm3) | 0,18 | 0,90 | 1,80 | 3,75 | 5,80 | 10,0 |
Titik didih (°C) | –269 | –246 | –186 | –153 | –108 | –62 |
Titik leleh (°C) | –272 | –249 | –189 | –157 | –112 | –71 |
Sumber: General Chemistry (Ebbing), 1990 | ||||||
Jika dilihat dari titik lelehnya, gas mulia berwujud gas pada suhu kamar. Pada tekanan normal, hampir semua gas mulia dapat dicairkan, kecuali gas helium. Gas helium hanya dapat dicairkan pada tekanan sangat tinggi sekitar 25 atm. Oleh karena gas helium merupakan gas yang memiliki titik leleh dan titik didih paling rendah maka gas tersebut sering digunakan sebagai pendingin untuk mempertahankan suhu di sekitar 0 K Pada 4 K, gas helium menunjukkan sifat super fluida tanpa viskositas, dinamakan super konduktor, yaitu zat yang memiliki daya hantar listrik dan panas tanpa hambatan dan tanpa medan magnet. Besarnya hantaran listrik mencapai 800 kali lebih cepat dibandingkan kawat tembaga.
Rangkuman :
- Dasar pengelompokan unsur-unsur dalam tabel periodik mengalami perkembangan, mulai model triade dari Dobereiner, model oktaf dari Newland, model Mendeleev, hingga model tabel periodik panjang.
- Sistem periodik modern menggunakan bentuk memanjang yang didasarkan pada kenaikan nomor atom. Struktur dasar tabel periodik modern adalah pengaturan unsur-unsur ke dalam baris (periode) dan kolom (golongan).
- Golongan merupakan kumpulan unsur-unsur yang terletak dalam satu lajur vertikal. Unsur-unsur segolongan memiliki kemiripan sifat kimia.
- Periode merupakan kumpulan unsur-unsur yang terletak dalam satu lajur horizontal. Unsur-unsur dalam periode yang sama cenderung sifatnya berubah seperti dari logam menuju bukan logam (dalam sistem periodik).
- Penempatan unsur-unsur dalam sistem periodik berhubungan dengan konfigurasi elektronnya. Nomor pada golongan mencerminkan elektron valensinya, sedangkan nomor periode berhubungan jumlah orbit.
- Umumnya jari-jari atom unsur-unsur seperiode dari kiri ke kanan berkurang secara periodik. Demikian pula dari bawah ke atas dalam golongan yang sama, yaitu jari-jari atom berkurang.
- Umumnya, energi ionisasi dalam golongan yang sama dari bawah ke atas meningkat. Demikian pula pada periode yang sama, yaitu dari kiri ke kanan meningkat.
- Secara umum, afinitas elektron dalam golongan yang sama dari bawah ke atas bertambah. Demikian pula pada periode yang sama dari kiri ke kanan, afinitas elektron bertambah.
- Unsur-unsur golongan IA dinamakan golongan alkali, IIA golongan alkali tanah, VIIA golongan halogen, dan VIIIA golongan gas mulia. Nomor golongan sesuai dengan jumlah elektron pada kulit terluar (elektron valensi) dari atom.
Anda sekarang sudah mengetahui Sistem Periodik Unsur. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Mudah dan Aktif Belajar Kimia 1 : Untuk Kelas X Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 226.
















{ 0 komentar... Views All / Send Comment! }
Posting Komentar