Artikel dan Makalah tentang Temperatur, Perpindahan Kalor, Pemuaian Zat : Pengertian, Pengukuran, dan Perubahan - Pada bab ini, Anda akan diajak untuk dapat menerapkan konsep kalor dan prinsip konservasi energi pada berbagai perubahan energi dengan cara menganalisis pengaruh kalor terhadap suatu zat, cara perpindahan kalor, serta dapat menerapkan Asas Black dalam pemecahan masalah. Anda akan merasakan panas jika berada dekat dengan api yang menyala. Begitu pula jika Anda memanaskan sebuah logam pada api yang menyala, Anda akan merasakan logam tersebut menjadi panas dan mungkin Anda tidak sanggup memegangnya. Mengapa dapat terjadi perpindahan panas, sedangkan Anda tidak menyentuh sumber panasnya tersebut? Kejadian ini dapat juga disebut sebagai perpindahan kalor yang memiliki arti dapat menghantarkan dan menyerap energi. Perubahan wujud zat sering terjadi pada kehidupan sehari-hari dan mungkin sering Anda jumpai. Ketika sebuah es dipanaskan, es tersebut akan berubah wujudnya menjadi air. Begitu pula jika air didinginkan pada sebuah lemari es, air tersebut akan berubah wujudnya menjadi es. Tahukah Anda, mengapa dapat terjadi perubahan wujud seperti itu? Untuk lebih memahami materi mengenai zat dan kalor serta perpindahannya, pelajari bahasan-bahasan berikut ini dengan baik.
A. Pengertian Temperatur
Sangatlah sulit untuk memberikan definisi temperatur berdasarkan konsep yang umum digunakan, seperti pada besaran lain. Namun demikian, Anda dapat menggunakan adanya kesepadanan (equality) perubahan temperatur terhadap perubahan sifat lain dari suatu benda. Temperatur dapat didefinisikan sebagai sifat fisik suatu benda untuk menentukan apakah keduanya berada dalam kesetimbangan termal. Dua buah benda akan berada dalam kesetimbangan termal jika keduanya memiliki temperatur yang sama.
1. Pengukuran Temperatur
Apabila dua benda berada dalam kesetimbangan termal dengan benda ketiga maka keduanya berada dalam kesetimbangan termal. Pernyataan seperti ini dikenal sebagai hukum ke nol termodinamika, yang sering mendasari pengukuran temperatur. Materi mengenai termodinamika akan Anda pelajari lebih mendalam di Kelas XI. Berdasarkan prinsip ini, jika Anda ingin mengetahui apakah dua benda memiliki temperatur yang sama maka kedua benda tersebut tidak perlu disentuh dan diamati perubahan sifatnya terhadap waktu, yang perlu dilakukan adalah mengamati apakah kedua benda tersebut, masing-masing berada dalam kesetimbangan termal dengan benda ketiga? Benda ketiga tersebut adalah termometer.
Benda apapun yang memiliki sedikitnya satu sifat yang berubah terhadap perubahan temperatur dapat digunakan sebagai termometer. Sifat semacam ini disebut sebagai sifat termometrik (thermometric property). Senyawa yang memiliki sifat termometrik disebut senyawa termometrik. Temperatur zat yang diukur sama besarnya dengan skala yang ditunjukkan oleh termometer saat terjadi kesetimbangan termal antara zat dengan termometer. Jadi, temperatur yang ditunjukkan oleh termometer sama dengan temperatur zat yang diukur.
Zat cair yang umum digunakan dalam termometer adalah air raksa. Hal ini dikarenakan air raksa memiliki keunggulan dibandingkan zat cair lainnya. Keunggulan air raksa dari zat cair lainnya, yaitu
- dapat menyerap panas suatu benda yang akan diukur sehingga temperatur air raksa sama dengan temperatur benda yang diukur,
- dapat digunakan untuk mengukur temperatur yang rendah hingga temperatur yang lebih tinggi karena air raksa memiliki titik beku pada temperatur –39 °C dan titik didihnya pada temperatur 357 °C,
- tidak membasahi dinding tabung sehingga pengukurannya menjadi lebih teliti,
- pemuaian air raksa teratur atau linear terhadap kenaikan temperatur, kecuali pada temperatur yang sangat tinggi, dan
- mudah dilihat karena air raksa dapat memantulkan cahaya.
Selain air raksa, dapat juga digunakan alkohol untuk mengisi tabung termometer. Akan tetapi, alkohol tidak dapat mengukur temperatur yang tinggi karena titik didihnya 78 °C, namun alkohol dapat mengukur temperatur yang lebih rendah karena titik bekunya pada temperatur –144 °C. Jadi, termometer yang berisi alkohol baik untuk mengukur temperatur yang rendah, tetapi tidak dapat mengukur temperatur yang lebih tinggi.
2. Skala pada Beberapa Termometer
Ketika mengukur temperatur dengan menggunakan termometer, terdapat beberapa skala yang digunakan, di antaranya skala Celsius, skala Reamur, skala Fahrenheit, dan skala Kelvin. Keempat skala tersebut memiliki perbedaan dalam pengukuran suhunya. Berikut rentang temperatur yang dimiliki setiap skala.
a. Termometer skala Celsius
Memiliki titik didih air 100 °C dan titik bekunya 0 °C. Rentang temperaturnya berada pada temperatur 0 °C – 100 °C dan dibagi dalam 100 skala.
b. Temometer skala Reamur
Memiliki titik didih air 80 °R dan titik bekunya 0 °R. Rentang temperaturnya berada pada temperatur 0 °R – 80 °R dan dibagi dalam 80 skala.
c. Termometer skala Fahrenheit
Memiliki titik didih air 212 °F dan titik bekunya 32 °F. Rentang temperaturnya berada pada temperatur 32 °F – 212 °F dan dibagi dalam 180 skala.
d. Termometer skala Kelvin
Memiliki titik didih air 373,15 K dan titik bekunya 273,15 K. Rentang temperaturnya berada pada temperatur 273,15 K – 373,15 K dan dibagi dalam 100 skala. Jadi, jika diperhatikan pembagian skala tersebut, satu skala dalam derajat Celsius sama dengan satu skala dalam derajat Kelvin, sementara satu skala Celsius kurang dari satu skala Reamur dan satu skala Celsius lebih dari satu skala Fahrenheit. Secara matematis perbandingan keempat skala tersebut, yaitu sebagai berikut.
Mengukur Temperatur
Temperatur zat apapun langsung berkaitan dengan ratarata energi gerak atom atau molekul pembentuknya. Walaupun temperatur terendah pada termometer ini (0 – 2) °C atau (0 – 4) °F, temperatur yang terendah yang dapat dicapai lebih kurang (0 – 273)°C atau –459 °F yang disebut temperatur nol mutlak. Temperatur ini hanya dapat dijumpai apabila atom dan molekul tidak lagi mengandung energi gerak sama sekali. Celsius (C) dan Fahrenheit (F) adalah dua skala temperatur yang paling lazim digunakan. (Sumber: Jendela Iptek, 1997)
Contoh Soal 1 :
Misalkan Ucok membuat sebuah termometer yang disebut dengan termometer X. Pada termometer ini air membeku pada 0 °X dan air mendidih pada 150 °X. Bagaimanakah hubungan termometer ini dengan termometer dalam skala Celsius?
Kunci Jawaban :
Pada termometer X, rentang temperatur yang dimilikinya, yakni dari 0 °X – 150 °X sehingga skala pada termometer ini dibagi dalam 150 skala. Perbandingan antara termometer X dan termometer Celsius, yakni :
Jadi, hubungan antara termometer ini dengan termometer Celsius adalah t °C = 2/3 t °X.
B. Pemuaian Zat
Anda mungkin pernah melihat sambungan rel kereta api dibuat renggang atau bingkai kaca lebih besar daripada kacanya. Hal ini dibuat untuk menghindari akibat dari terjadinya pemuaian. Pemuaian terjadi jika benda yang dapat memuai diberi panas. Ada 3 jenis pemuaian jenis zat, yaitu pemuaian zat padat, pemuaian zat cair, dan pemuaian zat gas. Pada bab ini hanya akan dibahas pemuaian zat padat.
1. Pemuaian Panjang
Jika temperatur dari sebuah benda naik, kemungkinan besar benda tersebut akan mengalami pemuaian. Misalnya, sebuah benda yang memiliki panjang L0 pada temperatur T akan mengalami pemuaian panjang sebesar ΔL jika temperatur dinaikan sebesar ΔT. Secara matematis, perumusan pemuaian panjang dapat dituliskan sebagai berikut.
ΔL = α L0ΔT (1-1)
dengan α adalah koefisien muai panjang.
Satuan dari α adalah kebalikan dari satuan temperatur skala Celsius (1/°C) atau kelvin (1/K). Tabel berikut ini menunjukkan nilai dari koefisien muai panjang untuk berbagai zat.
Bahan | Α (1/K) |
Aluminium | 24 × 10–6 |
Kuningan | 19 × 10–6 |
Karbon | |
· Intan | 1,2 × 10–6 |
· Grafit | 7,9 × 10–6 |
Tembaga | 17 × 10–6 |
Gelas | |
· Biasa | 9 × 10–6 |
· Pyrex | 3,2 × 10–6 |
Es | 51 × 10–6 |
Invar | 1 × 10–6 |
Baja | 11 × 10–6 |
Sumber: Physics, 1995 | |
Contoh Soal 2 :
Sebuah kuningan memiliki panjang 1 m. Tentukanlah pertambahan panjang kuningan tersebut jika temperaturnya naik dari 10 °C sampai 40 °C.
Kunci Jawaban :
Diketahui: L0 = 1 m,
ΔT = 40 °C – 10 °C = 30 °C = 303,15 K, dan
α kuningan = 19 × 10–6/K.
ΔL = α L0 ΔT
ΔL = (19 × 10–6/K) (1 m) (303,15 K)
ΔL = 5,76 × 10–3 = 5,76 mm
Jadi, pertambahan panjang kuningan setelah temperaturnya naik menjadi 40° adalah 5,76 mm.
2. Pemuaian Luas
Sebuah benda yang padat, baik bentuk persegi maupun silinder, pasti memiliki luas dan volume. Seperti halnya pada pemuaian panjang, ketika benda dipanaskan, selain terjadi pemuaian panjang juga akan mengalami pemuaian luas. Perumusan pada pemuaian luas hampir sama seperti pada pemuaian panjang, yaitu sebagai berikut :
ΔA = βΔ0AT (1-3)
dengan β adalah koefisien muai luas.
satuan dari β adalah /K sama seperti koefisien muai panjang (α).
 |
| Gambar 2. Logam berbentuk persegi jika dipanaskan akan memuai. |
Coba Anda perhatikan sebuah tembaga berbentuk persegi sama sisi. Misalkan, panjang sisi tembaga adalah L0 maka luas tembaga adalah L02. Jika tembaga tersebut dipanasi sampai terjadi perubahan temperatur sebesar ΔT maka sisi-sisi tembaga akan memuai dan panjang sisi tembaga menjadi L0 + ΔT. Luas tembaga setelah memuai akan berubah menjadi (L0 + ΔT)2 dan perubahan luas setelah pemuaian adalah :
ΔA = (L0+ ΔL)2 – L02
ΔA = L02+ 2L0ΔL + ΔL2 – L02
ΔA = 2L0ΔL + ΔL2
dari perumusan koefisien muai luas, yaitu :
Oleh karena perubahan panjang ΔL tembaga sangatlah kecil maka nilai ΔL2 dapat diabaikan. Jika ditulis ulang, persamaan tersebut menjadi :
seperti yang telah Anda ketahui bahwa :
maka,
β = 2α (1-5)
Contoh Soal 3 :
Sebuah batang aluminium memiliki luas 100 cm2. Jika batang aluminium tersebut dipanaskan mulai dari 0 °C sampai 30 °C, berapakah perubahan luasnya setelah terjadi pemuaian? (Diketahui: α = 24 × 10–6/K).
Kunci Jawaban :
Diketahui:
A0 = 100 cm2 = 1 m2,
ΔT = 30 °C – 0 °C = 30 °C = 303,15 K, dan
β = 2α = 48 × 10–6/K.
ΔA = β A0ΔT
ΔA = 48 × 10–6/K × 1 m2 × 303,15 K
ΔA = 0,0145 m2
Jadi, perubahan luas bidang aluminium setelah pemuaian adalah 0,0145 m2.
3. Pemuaian Volume
Seperti yang telah dibahas sebelumnya, setiap benda yang padat pasti memiliki volume. Jika panjang sebuah benda dapat memuai ketika dipanaskan maka volume benda tersebut juga ikut memuai. Perumusan untuk pemuaian volume sama dengan perumusan panjang dan luas, yaitu :
dengan γ adalah koefisien muai volume .
Perlu Anda ketahui terdapat hubungan antara α dan β terhadap waktu γ, yaitu :
γ = 3α
γ = 3/2 β (1-8)
Contoh Soal 4 :
Sebuah bola yang memiliki volume 50 m3 jika dipanaskan hingga mencapai temperatur 50 °C. Jika pada kondisi awal kondisi tersebut memiliki temperatur 0 °C, tentukanlah volume akhir bola tersebut setelah terjadi pemuaian (Diketahui α = 17 × 10–6/K)
Kunci Jawaban :
Diketahui :
V0 = 50 m3,
ΔT = 50°C – 0°C = 50°C = 323,15 K, dan
γ = 3α = 51 × 10–6/K.
ΔV = γVoΔT
ΔV = 51 × 10–6/K × 50 m3 × 323,15 K
ΔV = 0,82 m3
ΔV = V – Vo
V = ΔV + Vo
V = 0,82 m3 + 50 m3 = 50,82 m3
Jadi, volume akhir bola setelah pemuaian adalah 50,82 m3.
Percobaan Fisika Sederhana 1 :
Sediakanlah sebuah gelas kaca dan sebuah gelas plastik atau gelas keramik (mug). Masukkan air mendidih (100 °C) kepada kedua gelas tersebut. Amatilah apa yang terjadi. Mengapa gelas kaca pecah, sedangkan gelas plastik atau gelas keramik tidak pecah? Apakah ada hubungannya dengan konsep pemuaian? Coba Anda jelaskan dengan menggunakan bahasa Anda sendiri. Jika perlu, diskusikan bersama teman atau guru Anda dan presentasikan hasilnya di depan kelas.
C. Pengertian Kalor
Misalkan, dua buah zat yang memiliki temperatur berbeda dicampurkan pada sebuah wadah. Maka temperatur kedua benda tersebut akan menjadi sama. Besarnya temperatur akhir berada di antara temperatur awal kedua zat tersebut. Pada gejala ini, kalor berpindah dari temperatur tinggi ke temperatur yang lebih rendah hingga mencapai temperatur setimbangnya. Pada 1850, untuk pertama kalinya Joule menggunakan sebuah alat yang di dalamnya terdapat beban-beban yang jatuh dan merotasikan sekumpulan pengaduk di dalam sebuah wadah air yang tertutup. Dalam satu siklus, beban-beban yang jatuh tersebut melakukan sejumlah kerja pada air tersebut dengan massa air adalah m dan air tersebut mengalami kenaikan temperatur sebesar Δt. Percobaan ini menerangkan tentang adanya energi yang menyebabkan timbulnya kalor dalam siklus tersebut.
Kalor dapat didefinisikan sebagai proses transfer energi dari suatu zat ke zat lainnya dengan diikuti perubahan temperatur. Satuan kalor adalah joule (J) yang diambil dari nama seorang ilmuwan yang telah berjasa dalam bidang ilmu Fisika, yaitu James Joule. Satuan kalor lainnya adalah kalori. Hubungan satuan joule dan kalori, yakni 1 kalori = 4,184 joule.
1. Kalor Jenis dan Kapasitas Kalor
Apabila temperatur dari suatu benda dinaikkan dengan besar kenaikan temperatur yang sama, ternyata setiap benda akan menyerap energi kalor dengan besar yang berbeda. Misalnya, terdapat empat buah bola masing-masing terbuat dari aliminium, besi, kuningan, dan timah. Keempat bola ini memiliki massa sama dan ditempatkan di dalam suatu tempat yang berisi air mendidih. Setelah 30 menit, keempat bola akan mencapai kesetimbangan termal dengan air dan akan memiliki temperatur yang sama dengan temperatur air. Kemudian, keempat bola diangkat dan ditempatkan di atas kepingan parafin. Bola aluminium dapat melelehkan parafin dan jatuh menembus parafin. Beberapa sekon kemudian, bola besi mengalami kejadian yang sama. Bola kuningan hanya dapat melelehkan parafin sebagian, sedangkan bola timah hampir tidak dapat melelehkan parafin.
Bagaimanakah Anda dapat menjelaskan kejadian yang terjadi pada keempat bola tersebut? Keempat bola tersebut menyerap kalor dari air mendidih, kemudian memindahkan kalor tersebut pada parafin sehingga parafin meleleh. Oleh karena setiap benda memiliki kemampuan berbeda untuk melelehkan parafin, setiap bola akan memindahkan kalor dari air ke parafin dengan besar yang berbeda. Kemampuan yang dimiliki setiap benda ini berhubungan dengan kalor jenis benda tersebut. Kalor jenis suatu benda dapat didefinisikan sebagai jumlah kalor yang diperlukan untuk menaikkan temperatur 1 kg suatu zat sebesar 1K. Kalor jenis menunjukkan kemampuan suatu benda untuk menyerap kalor. Semakin besar kalor jenis suatu benda, semakin besar pula kemampuan benda tersebut untuk menyerap kalor. Secara matematis, kalor jenis suatu zat dapat dituliskan sebagai berikut.
dengan:
c = kalor jenis suatu zat (J/kg K),
Q = kalor (J),
m = massa benda (kg), dan
ΔT = perubahan temperatur (K).
Untuk suatu benda, faktor mc dipandang sebagai satu kesatuan dan faktor ini disebut sebagai kapasitas kalor. Secara matematis dituliskan sebagai berikut.
Satuan kapasitas kalor adalah J/K. Jika Persamaan (1–9) dan Persamaan (1–10) diuraikan, besarnya kalor suatu zat adalah :
Q = m cΔT (1-11)
Q = C ΔT (1-12)
Contoh Soal 5 :
Energi kalor yang diperlukan untuk memanaskan air dari 30 °C sampai dengan 80 °C dengan massa air 500 gram (cair = 4.200 J/kgK) adalah ....
a. 350.000 joule
b. 378.000 joule
c. 252.000 joule
d. 152.000 joule
e. 105.000 joule
Kunci Jawaban :
Diketahui:
m = 500
g = 0,5 kg,
g = 0,5 kg,
c = 4.200 J/kgK, dan
ΔT = (80–30) °C = 50 °C.
Q = mc ΔT
Q = (0,5 kg) × (4.200 J/kgK) × (50 °C)
Q = 105.000 joule
Jawab : e
Contoh Soal 6 :
Air sebanyak 100 gram yang memiliki temperatur 25 °C dipanaskan dengan energi sebesar 1.000 kalori. Jika kalor jenis air 1 kal/g oC, tentukanlah temperatur air setelah pemanasan tersebut.
Kunci Jawaban :
Diketahui:
m = 100 gram,
m = 100 gram,
T0 = 25 °C,
cair = 1 kal/g °C, dan
Q = 1.000 kal.
Dengan menggunakan Persamaan (1–11), diperoleh :
Q = mc ΔT
ΔT = Q / mc = (1.000 kal) / (100 gram × 1 kal/g °C)
ΔT = 10°C
Perubahan temperatur memiliki arti selisih antara temperatur akhir air setelah pemanasan terhadap temperatur awal, atau secara matematis dituliskan sebagai berikut.
ΔT = T – T0
10 °C = T – 25 °C
T = 35 °C
Jadi, temperatur akhir air setelah pemanasan adalah 35 °C.
2. Perubahan Wujud Zat
Setiap zat memiliki kecenderungan untuk berubah jika zat tersebut diberikan temperatur yang tinggi (dipanaskan) ataupun temperatur yang rendah (didinginkan). Kecenderungan untuk berubah wujud ini disebabkan oleh kalor yang dimiliki setiap zat. Suatu zat dapat berubah menjadi tiga wujud zat, di antaranya cair, padat, dan gas. Perubahan wujud zat ini diikuti dengan penyerapan dan pelepasan kalor.
a. Kalor Penguapan dan Pengembunan
Kalor penguapan adalah kalor yang dibutuhkan oleh suatu zat untuk menguapkan zat tersebut. Jadi, setiap zat yang akan menguap membutuhkan kalor. Adapun kalor pengembunan adalah kalor yang dilepaskan oleh uap air yang berubah wujud menjadi air. Jadi, pada setiap pengembunan akan terjadi pelepasan kalor. Besarnya kalor yang dibutuhkan pada saat penguapan dan kalor yang dilepaskan pada saat pengembunan adalah sama. Secara matematis, kalor penguapan dan pengembunan dapat dituliskan sebagai berikut.
Q = m L (1-13)
dengan :
Q = kalor yang dibutuhkan saat penguapan atau kalor yang dilepaskan saat pengembunan,
m = massa zat, dan
L = kalor laten penguapan atau pengembunan.
b. Kalor Peleburan dan Pembekuan
Pernahkah Anda mendengar atau menerima informasi tentang peristiwa mencairnya gunung-gunung es di kutub utara akibat pemanasan global? Mencair atau meleburnya es di kutub utara disebabkan oleh adanya pemanasan. Jika benda mengalami peleburan, perubahan wujud yang terjadi adalah dari wujud zat padat menjadi zat cair. Dalam hal ini, akan terjadi penyerapan kalor pada benda. Adapun perubahan wujud zat dari cair ke padat disebut sebagai proses pembekuan. Dalam hal ini, akan terjadi proses pelepasan kalor. Besarnya kalor yang dibutuhkan pada saat peleburan dan besarnya kalor yang dilepaskan dalam proses pembekuan adalah sama. Perumusan untuk kalor peleburan dan pembekuan sama dengan perumusan pada kalor penguapan dan pengembunan, yakni sebagai berikut.
Q = m L (1–14)
dengan :
Q = kalor yang dibutuhkan saat peleburan atau kalor yang dilepaskan saat pembekuan,
m = massa zat, dan
L = kalor laten peleburan atau pembekuan.
Contoh Soal 7 :
Berapakah besarnya kalor yang dibutuhkan untuk mencairkan es sebanyak 500 gram pada temperatur 0 °C menjadi cair seluruhnya yang memiliki temperatur 10 °C Diketahui kalor laten peleburan es menjadi air sebesar 80 kal/g.
Kunci Jawaban :
Diketahui:
L = 80 kal/g, dan
L = 80 kal/g, dan
m = 500 gram.
Dengan menggunakan Persamaan (1–14), diperoleh
Q = m L
Q = 500 gram × 80 kal/g
Q = 40.000 kal
Q = 40 kkal
Jadi, besarnya kalor yang dibutuhkan untuk meleburkan es menjadi cair seluruhnya adalah sebesar 40 kkal.
Contoh Soal 8 :
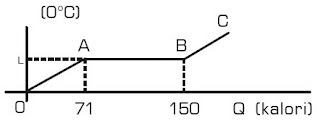
Grafik berikut ini menyatakan hubungan antara temperatur (t) dengan kalor (Q) yang diberikan pada 1 gram zat padat.
Besar kalor lebur zat padat tersebut adalah ....
a. 71 kalori/g
b. 79 kalori/g
c. 80 kalori/g
d. 811 kalori/g
e. 150 kalori/g
Kunci Jawaban :
Diketahui:
mzat = 1 gram.
Zat padat tersebut mengalami peleburan pada temperatur 1 (grafik AB). Pada kurva AB.
ΔQ = 150 – 71 = 79 kal.
Dengan demikian, kalor lebur zat padat dapat dihitung sebagai berikut :
ΔT = mQ
Q = ΔT / m = 79 / 1 = 79 kal/gram
3. Hubungan Kalor Laten dan Perubahan Wujud
Sebuah benda dapat berubah wujud ketika diberi kalor. Coba Anda perhatikan perilaku suatu benda ketika dipanaskan. Apabila suatu zat padat, misalnya es dipanaskan, es tersebut akan menyerap kalor dan beberapa lama kemudian berubah wujud menjadi zat cair. Perubahan wujud zat dari padat menjadi cair ini disebut proses melebur. Temperatur pada saat zat mengalami peleburan disebut titik lebur zat. Adapun proses perubahan wujud zat dari cair menjadi padat disebut sebagai proses pembekuan dan temperatur ketika zat mengalami proses pembekuan disebut titik beku zat.
Jika zat cair dipanaskan akan menguap dan berubah wujud menjadi gas. Perubahan wujud dari zat cair menjadi uap (gas) disebut menguap. Pada peristiwa penguapan dibutuhkan kalor. Proses penguapan dapat terjadi dalam kehidupan sehari-hari, misalnya Anda mencelupkan tangan Anda ke dalam cairan spiritus atau alkohol. Spiritus atau alkohol adalah zat cair yang mudah menguap. Untuk melakukan penguapan ini, spiritus atau alkohol menyerap panas dari tangan Anda sehingga tangan Anda terasa dingin. Peristiwa lain yang memperlihatkan bahwa proses penguapan membutuhkan kalor adalah pada air yang mendidih. Penguapan hanya terjadi pada permukaan zat cair dan dapat terjadi pada sembarang temperatur, sedangkan mendidih hanya terjadi pada seluruh bagian zat cair dan hanya terjadi pada temperatur tertentu yang disebut dengan titik didih. Proses kebalikan dari menguap adalah mengembun, yakni perubahan wujud dari uap menjadi cair.
Ketika sedang berubah wujud, baik melebur, membeku, menguap, dan mengembun, temperatur zat akan tetap, walaupun terdapat pelepasan atau penyerapan kalor. Dengan demikian, terdapat sejumlah kalor yang dilepaskan atau diserap pada saat perubahan wujud zat, tetapi tidak digunakan untuk menaikkan atau menurunkan temperatur. Kalor ini disebut sebagai kalor laten dan disimbolkan dengan huruf L. Besarnya kalor ini bergantung pada jumlah zat yang mengalami perubahan wujud (massa benda). Jadi, kalor laten adalah kalor yang dibutuhkan oleh suatu benda untuk mengubah wujudnya per satuan massa.
Mengapa kalor yang diserap oleh suatu zat padat ketika melebur atau menguap tidak dapat menaikkan temperaturnya? Berdasarkan teori kinetik, pada saat melebur atau menguap, kecepatan getaran molekul bernilai maksimum. Kalor yang diserap tidak menambah kecepatannya, tetapi digunakan untuk melawan gaya ikat antarmolekul zat tersebut.
Ketika molekul-molekul ini melepaskan diri dari ikatannya, zat padat berubah menjadi zat cair atau zat cair berubah menjadi gas. Setelah seluruh zat padat melebur atau menguap, temperatur zat akan bertambah kembali. Peristiwa kebalikannya terjadi juga pada saat melebur, membeku, atau mengembun.
Kalor laten pembekuan besarnya sama dengan kalor laten peleburan yang disebut sebagai kalor lebur. Kalor lebur es L pada temperatur dan tekanan normal adalah 334 kJ/kg. Kalor laten penguapan besarnya sama dengan kalor laten pengembunan, yang disebut sebagai kalor uap. Kalor uap air L pada temperatur dan tekanan normal adalah 2.256 kJ/kg.
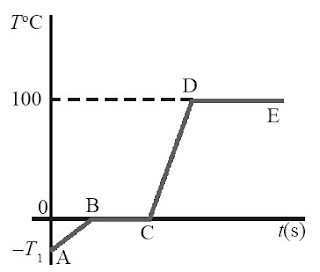 |
| Gambar 3. Grafik perubahan temperatur dan berubahan wujud zat pada sebuah es. |
Perhatikan Gambar 3. yang menunjukkan proses perubahan temperatur dan wujud zat pada sebuah es. Dari gambar tersebut terdapat proses perubahan temperatur dan wujud zat yang terjadi, yakni sebagai berikut.
a. Proses A – B merupakan proses kenaikan temperatur dari sebongkah es. Pada proses kenaikan temperatur ini, grafik yang terjadi adalah linear. Pada grafik AB, kalor digunakan untuk menaikkan temperatur.
QAB = mes ces ΔT
QAB = mesces (0oC – (–T1))
QAB = mes ces T1
b. Proses B – C merupakan proses perubahan wujud zat dari es menjadi air. Pada grafik BC, kalor tidak digunakan untuk menaikkan atau menurunkan temperatur benda, tetapi hanya digunakan untuk mengubah wujud zat benda tersebut, yakni dari wujud es menjadi air.
QBC = mes L
c. Pada grafik C – D, terjadi proses kenaikan temperatur yang sama dengan proses pada (a). Akan tetapi, pada proses ini yang dinaikkan suhunya adalah air dari 0 °C sampai 100 °C.
QCD = mair cair ΔT
QCD = maircair (100 °C – 0 °C)
QCD = mair cair100 °C
d. Sama halnya pada proses B – C, proses D – E tidak mengalami perubahan temperatur, tetapi yang terjadi hanya perubahan wujud zat dari air menjadi uap.
QDE = mair L
Contoh Soal 9 :
Es yang massanya 125 gram dan memiliki temperatur 0 °C, dimasukkan ke dalam 500 gram air yang memiliki temperatur 20 °C. Ternyata, es melebur seluruhnya. Jika kalor lebur es = 80 kalori/gram °C, temperatur akhir campuran adalah ....
a. 0°C
b. 5°C
c. 10°C
d. 15°C
e. 20°C
Kunci Jawaban :
Jawab: a
4. Asas Black
Es yang massanya 125 gram dan memiliki temperatur 0 °C, dimasukkan ke dalam 500 gram air yang memiliki temperatur 20 °C. Ternyata, es melebur seluruhnya. Jika kalor lebur es = 80 kalori/gram °C, temperatur akhir campuran adalah ....
a. 0°C
b. 5°C
c. 10°C
d. 15°C
e. 20°C
Kunci Jawaban :
mair cair Δair= mcampuran ccampuran Δcampuran + mes
500 × 1 × (20 – takhir) = 625 × 1 × (takhir – 0) + 125 × 80
10.000 – 500 takhir= 625 takhir + 10.000
625 takhir + 500 takhir = 10.000 – 10.000
1.125 takhir= 0
takhir = 0 °CJawab: a
4. Asas Black
Kalor adalah energi yang dipindahkan dari benda yang memiliki temperatur tinggi ke benda yang memiliki temperatur lebih rendah sehingga pengukuran kalor selalu berhubungan dengan perpindahan energi. Energi adalah kekal sehingga benda yang memiliki temperatur lebih tinggi akan melepaskan energi sebesar QL dan benda yang memiliki temperatur lebih rendah akan menerima energi sebesar QT dengan besar yang sama.
Secara matematis, pernyataan tersebut dapat ditulis sebagai berikut.
QLepas = QTerima (1-15)
Persamaan (1–15) menyatakan hukum kekekalan energi pada pertukaran kalor yang disebut sebagai Asas Black. Nama hukum ini diambil dari nama seorang ilmuwan Inggris sebagai penghargaan atas jasa-jasanya, yakni Joseph Black (1728–1799). Pengukuran kalor sering dilakukan untuk menentukan kalor jenis suatu zat. Jika kalor jenis suatu zat diketahui, kalor yang diserap atau dilepaskan dapat ditentukan dengan mengukur perubahan temperatur zat tersebut. Kemudian, dengan menggunakan persamaan
Q = m c ΔT
besarnya kalor dapat dihitung. Ketika menggunakan persamaan ini, perlu diingat bahwa temperatur naik berarti zat menerima kalor, dan temperatur turun berarti zat melepaskan kalor.
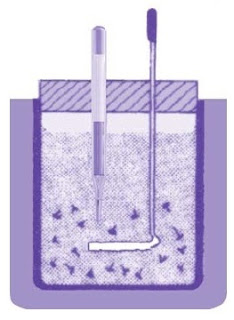 |
| Gambar 4. Kalorimeter sebagai alat ukur kalor. |
Kalorimeter adalah alat yang digunakan untuk mengukur kalor. Salah satu bentuk kalorimeter, tampak pada Gambar 4. Kalorimeter ini terdiri atas sebuah bejana logam dengan kalor jenisnya telah diketahui. Bejana ini biasanya ditempatkan di dalam bejana lain yang agak lebih besar. Kedua bejana dipisahkan oleh bahan penyekat, misalnya gabus atau wol. Kegunaan bejana luar adalah sebagai pelindung agar pertukaran kalor dengan lingkungan di sekitar kalorimeter dapat dikurangi. Kalorimeter juga dilengkapi dengan batang pengaduk. Pada waktu zat dicampurkan di dalam kalorimeter, air di dalam kalorimeter perlu diaduk agar diperoleh temperatur merata dari percampuran dua zat yang suhunya berbeda. Batang pengaduk ini biasanya terbuat dan bahan yang sama seperti bahan bejana kalorimeter. Zat yang diketahui kalor jenisnya dipanaskan sampai temperatur tertentu. Kemudian, zat tersebut dimasukkan ke dalam kalorimeter yang berisi air dengan temperatur dan massanya yang telah diketahui. Selanjutnya, kalorimeter diaduk sampai suhunya tetap.
Tokoh Fisika :
Joseph Black mengira bahwa kapasitas panas merupakan jumlah panas yang dapat ditampung oleh suatu benda. Hal ini sebenarnya merupakan ukuran tentang jumlah tenaga yang diperlukan untuk menaikan temperatur suatu benda dalam jumlah tertentu. Misalnya, untuk menaikkan temperatur 1 kg (2,2 lb) air sebesar 1 °C (1,8 °F) dibutuhkan lebih banyak panas daripada menaikkan temperatur 1 kg besi dengan kenaikan temperatur yang sama. (Sumber: Jendela Iptek, 1997)
D. Perpindahan Kalor
Pada sebuah benda, perpindahan kalor atau perambatan kalor terjadi dari benda yang bersuhu tinggi ke benda yang bersuhu rendah. Kalor dapat merambat dengan tiga cara, di antaranya secara konduksi (hantaran), secara konveksi (aliran), dan secara radiasi (pancaran). Berikut pembahasan mengenai setiap jenis perambatan kalor tersebut.
1. Perpindahan Kalor Secara Konduksi
Jika salah satu ujung batang logam dimasukkan ke dalam api atau dipanaskan, ujung batang yang lainnya akan ikut menjadi panas, walaupun tidak ikut dimasukkan ke dalam api. Mengapa demikian? Atom-atom di dalam zat padat yang dipanaskan tersebut akan bergetar dengan sangat kuat. Kemudian, atom-atom tersebut akan memindahkan sebagian energi yang dimilikinya ke atom-atom tetangga terdekat yang ditumbuknya. Atom tetangga ini menumbuk atom tetangga lainnya dan seterusnya sehingga terjadi hantaran energi di dalam zat padat tersebut. Untuk bahan logam, terdapat elektron-elektron yang dapat bergerak bebas yang juga ikut berperan dalam merambatkan energi tersebut. Perpindahan kalor yang tidak diikuti perpindahan massa ini disebut konduksi.
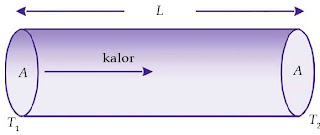 |
| Gambar 5. Rambatan kalor di dalam konduktor. |
Kalor yang mengalir dalam batang per satuan waktu dapat dinyatakan dalam hubungan:
dengan:
T1 = ujung batang logam bersuhu tinggi,
T1 = ujung batang logam bersuhu tinggi,
T2 = ujung batang logam bersuhu rendah,
A = luas penampang hantaran kalor dan batang logam,
L = panjang batang,
K = koefisien konduksi termal, dan
H = jumlah kalor yang merambat pada batang per satuan waktu per satuan luas.
Dalam kehidupan sehari-hari, contoh peristiwa konduksi ini dapat Anda temukan saat Anda memasak makanan. Panci yang digunakan untuk memasak akan mendapatkan panas atau kalor di setiap bagiannya, walaupun bagian panci yang terkena api hanyalah di bagian bawahnya. Perambatan kalor secara konduksi ini juga terjadi pada sendok yang digunakan. Oleh karena itu, tangkai sendok penggorengan dilapisi dengan bahan yang tidak menghantarkan kalor, seperti plastik atau kayu. Berikut tabel yang menyatakan nilai konduktivitas termal beberapa zat.
Tabel 2. Konduktivitas Termal Beberapa Zat
Zat/Bahan | K (Kj / ms K) |
Logam: Perak Tembaga Aluminium Kuningan Besi/Baja Zat Padat Lainnya: Beton Kaca Batu bata Kayu cemara Zat cair: Air Bahan isolator: Serbuk gergaji Gabus Wol gelas Kapuk Gas: Hidrogen Udara | 4,2 × 10-1 3,8 × 10-1 2,1 × 10-1 1,0 × 10-2 4,6 × 10-3 1,7 × 10-3 8,0 × 10-4 7,1 × 10-4 1,2 × 10-4 5,7 × 10-4 5,9 × 10-5 4,0 × 10-5 3,9 × 10-5 3,5 × 10-5 1,7 × 10-4 2,3 × 10-5 |
Sumber: Physics, 1995 | |
Contoh Soal 9 :
Batang aluminium (KAl = 500 × 10–1 kal/m s °C) luas penampang ujungnya 1 cm2 Ujung-ujung batang bertemperatur 0 °C dan 20 °C. Banyaknya kalor yang merambat tiap sekon adalah ....
a. 0,1 kal/s
b. 0,2 kal/s
c. 0,5 kal/s
d. 0,7 kal/s
e. 10 kal/s
Kunci Jawaban :
Diketahui:
KAl = 500 × 10–1 kal/m s °C,
AAl = 1 cm2 = 10–4 m2, dan
ΔT = (20 – 0) = 20 °C.
Banyaknya kalor yang merambat tiap sekon :
(di sini L dianggap 1 m), jadi :
H = KA ΔT
H = (500)(10–1) (20) (10–4)
H = 0,1 kal/s
Contoh Soal 10 :
Batang logam dengan panjang 2 meter, memiliki luas penampang 20 cm2 dan perbedaan temperatur kedua ujungnya 50 °C. Jika koefisien konduksi termalnya 0,2 kal/ms°C, tentukanlah jumlah kalor yang dirambatkan per satuan luas per satuan waktu.
Kunci Jawaban :
Diketahui:
K = 0,2 kal/ms °C,
L = 2 meter,
ΔT = 50 °C, dan
A = 20 cm2 = 2 × 10–3 m2.
Dengan menggunakan Persamaan (1–16), diperoleh :
H = 0,2 kal/ms°C × (2× 10–3 m2) × (50 °C / 2 m)
H = 0,01 kal/s
H = 0,01 kal/s
2. Perpindahan Kalor Secara Konveksi
Perambatan kalor yang disertai perpindahan massa atau perpindahan partikel- partikel zat perantaranya disebut perpindahan kalor secara aliran atau konveksi. Rambatan kalor konveksi terjadi pada fluida atau zat alir, seperti pada zat cair, gas, atau udara.
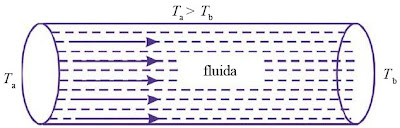 |
| Gambar 6. Rambatan kalor di dalam gas. |
Apabila dua sisi yang berhadapan dari silinder pada Gambar 6. suhunya berbeda, akan terjadi aliran kalor dari dinding yang bersuhu Ta ke dinding yang bersuhu Tb. Besarnya kalor yang merambat tiap satuan waktu, dapat dituliskan sebagai berikut.
H = hA ΔT (1-18)
dengan:
H = jumlah kalor yang berpindah tiap satuan waktu,
H = jumlah kalor yang berpindah tiap satuan waktu,
A = luas penampang aliran,
ΔT = perbedaan temperatur antara kedua tempat fluida mengalir, dan
h = koefisien konveksi termal.
Besarnya koefisien konveksi termal dari suatu fluida bergantung pada bentuk dan kedudukan geometrik permukaan-permukaan bidang aliran serta bergantung pula pada sifat fluida perantaranya.
Contoh Soal 10 :
Suatu fluida dengan koefisien konveksi termal 0,01 kal/ms °C memiliki luas penampang aliran 20 cm2. Jika fluida tersebut mengalir dari dinding yang bersuhu 100 °C ke dinding lainnya yang bersuhu 20 °C, kedua dinding sejajar. Berapakah besarnya kalor yang dirambatkan?
Kunci Jawaban :
Diketahui:
h = 0,01 kal/ms °C,
Ta = 100 °C,
Tb = 20 °C, dan
A = 20 cm2 = 2 × 10–3 m2.
Dengan menggunakan Persamaan (1–18), diperoleh
H = hA ΔT
H = 0,01 kal/ms °C × (2 × 10–3 m2) × (100 °C – 20 °C) = 16 × 10–4 kal/s
Jadi, besarnya kalor yang merambat dalam fluida per satuan waktu adalah 16 × 10–4 kal/s.
Catatan Fisika :
Lemari es membantu dingin dengan aliran arus konveksi. Udara dingin terdapat pada bagian atas lemari es, sementara udara hangat yang terdapat pada bagian bawah bergerak naik, kemudian menjadi lebih dingin.
3. Perpindahan Kalor Secara Radiasi
Matahari merupakan sumber energi utama bagi manusia di permukaan bumi ini. Energi yang dipancarkan Matahari sampai di Bumi berupa gelombang elektromagnetik. Cara perambatannya disebut sebagai radiasi, yang tidak memerlukan adanya medium zat perantara. Semua benda setiap saat memancarkan energi radiasi dan jika telah mencapai kesetimbangan termal atau temperatur benda sama dengan temperatur lingkungan, benda tersebut tidak akan memancarkan radiasi lagi. Dalam kesetimbangan ini, jumlah energi yang dipancarkan sama dengan jumlah energi yang diserap oleh benda tersebut.
Dari hasil percobaan yang dilakukan oleh Josef Stefan dan Ludwig Boltzmann, diperoleh besarnya energi per satuan luas per satuan waktu yang dipancarkan oleh benda yang bersuhu T, yakni
W = eσ T4 (1–19)
dengan:
W = energi yang dipancarkan per satuan luas per satuan waktu (watt/m2),
σ = konstanta Stefan–Boltzmann = 5,672 × 10–8 watt/m2 K4,
T = temperatur mutlak benda (K), dan
e = koefisien emisivitas (0 < e ≤ 1).
Percobaan Fisika Sederhana 2 :
Catatlah temperatur air panas yang berada di dalam sebuah wadah dengan menggunakan termometer. Kemudian, masukkan air dingin ke dalam wadah tersebut dan catat temperatur akhir campuran. Sebelumnya, catat massa air panas, air dingin, dan temperatur awal air dingin, kemudian tuliskan data hasil pengamatan Anda dalam bentuk tabel. Apa yang dapat Anda simpulkan? Laporkan hasil pengamatan kepada guru Anda dan persentasikan di depan kelas.
Contoh Soal 11 :
Suatu kalorimeter berisi es (kalor jenis es = 0,5 kal/gK, kalor lebur es = 80 kal/g) sebanyak 36 g pada temperatur – 6 °C. Kapasitas kalorimeter adalah 27 kal/K. Kemudian, ke dalam kalorimeter tersebut dituangkan alkohol (kalor jenis 0,58 kal/gK) pada temperatur 50° yang menyebabkan temperatur akhir menjadi 8 °C. Massa alkohol yang dituangkan (dalam gram) adalah ....
a. 108
b. 150
c. 200
d. 288
e. 300
Kunci Jawaban :
Diketahui:
Tes = –6 °C,
Tes = –6 °C,
C = 27 kal/K,
mes = 36 g,
ces = 0,5 kal/gK,
Les = 80 kal/g,
cair = 1 kal/gK,
Talkohol = 50°C,
cal = 0,58 kal/gK, dan
temperatur akhir T = 8 °C.
Berlaku Asas Black yang menyatakan kalor yang diserap sama dengan kalor yang dilepaskan. Es menyerap kalor, suhunya naik menjadi 0°C, kemudian melebur menjadi air, lalu naik suhunya menjadi 8 °C. Kalor yang diserap es adalah :
Qes = mes ces ΔT + mes Les+ mes ces ΔT
Qes = 36 × 0,5 × (0 – (–6)) + 36 × 80 + 36 × 1 × 8
Qes = 3.276 kalori
Pada kalorimeter, temperatur naik dari –6 °C menjadi 8 °C sehingga kalorimeter menyerap panas sebesar :
Qkal = C ΔT
Qkal = 27 × (8 – (–6))
Qkal= 378 kalori
Kalor yang dilepas alkohol diserap oleh es dan kalori meter sehingga
Qkal = Qes + Qkal
malkohol calkohol ΔT = 3.276 + 378
malkohol× 0,58 × 42 = 3.654
malkohol = 150 gram
Jadi, massa alkohol yang harus dituangkan supaya temperatur akhir menjadi 8 °C adalah sebesar 150 gram.
Jawab: d
Rangkuman :
1. Sifat fisik suatu benda untuk menentukan apakah telah terjadi kesetimbangan termal disebut dengan temperatur atau temperatur dan dapat diukur dengan alat yang disebut termometer.
2. Ketika mengukur temperatur dengan menggunakan termometer, terdapat beberapa skala yang digunakan, di antaranya skala Celsius, skala Reamur, skala Fahrenheit, dan skala Kelvin.
3. Jika suatu zat dipanaskan, akan mengalami pemuaian panjang, pemuaian luas, dan pemuaian volume.
4. Kalor didefinisikan sebagai perpindahan energi dari suatu zat ke zat lainnya dengan diikuti perubahan temperatur.
5. Kalor jenis suatu benda didefinisikan sebagai jumlah kalor yang diperlukan untuk menaikkan temperatur 1 kg suatu zat sebesar 1 K.
6. Besarnya kalor suatu benda dapat dituliskan ke dalam persamaan :
Q = mc Δt
7. Suatu zat dapat berubah menjadi tiga wujud zat, di antaranya cair, padat, dan gas. Perubahan wujud zat ini diikuti dengan penyerapan dan pelepasan kalor.
8. Kalor penguapan adalah kalor yang dibutuhkan oleh suatu zat untuk menguapkan zat tersebut.
9. Secara matematis, besarnya kalor peleburan, penguapan, pembekuan, dan penyubliman adalah
Q = mL
10. Asas Black mengatakan bahwa energi adalah kekal sehingga benda yang memiliki temperatur lebih tinggi akan melepaskan energi sebesar QLdan benda yang memiliki temperatur lebih rendah akan menerima energi sebesar QT dengan besar yang sama.
11. Kalor dapat merambat dengan tiga cara, di antaranya secara konduksi (hantaran), secara konveksi (aliran), dan secara radiasi (pancaran).
Anda sekarang sudah mengetahui Temperatur, Perpindahan Kalor, dan Pemuaian Zat. Terima kasih anda sudah berkunjung ke Perpustakaan Cyber.
Referensi :
Saripudin, A., D. Rustiawan K., dan A. Suganda. 2009. Praktis Belajar Fisika 1 : untuk Kelas 10 Sekolah Menengah Atas / Madrasah Aliyah Program Ilmu Pengetahuan Alam. Pusat Perbukuan Departemen Nasional, Departemen Pendidikan Nasional, Jakarta. 194 hlm.













{ 0 komentar... Views All / Send Comment! }
Posting Komentar